福建物构所新型近红外二区发光量子点生物标记获新进展
更新日期:2020-08-26近红外二区发光(950-1700 nm)在生物体内散射低、组织穿透深且成像分辨率高,在分析化学和生物医学等领域具有非常重要的应用前景。特别地,近红外二区无机量子点由于发射波长可调、吸收截面大和量子产率高等特性受到了国内外学者的广泛关注。目前主要研究的近红外二区量子点为II-VI族和IV-VI族半导体材料,如CdSe、CdTe和PbSe等,其中含有的重金属元素(如Cd2+和Pb2+等)极大地限制了其后续的生物医学应用。因此,开发具有良好生物相容性且高效发光的近红外二区量子点是目前生物标记领域的研究热点和难点。
中科院功能纳米结构设计与组装/福建省纳米材料重点实验室陈学元团队在中科院战略性先导科技专项和科技部国家重点研发专项等项目支持下,近期成功开发出CuInSe2(CISe)基新型高效近红外二区发光量子点生物探针,并首次将其应用于循环肿瘤细胞(CTC)检测和肿瘤靶向实时成像(图1)。该团队通过精准设计材料中的Se/In组分比,将CISe的发射峰位置由常规的920 nm调控至近红外二区1224 nm;所合成量子点的激发谱可覆盖紫外到近红外(350-820 nm)的宽带范围,在实际应用中可适用于多种波长的激发光源。包覆ZnS壳层后,CISe的稳定性得以显著提升,且在808 nm激发下其近红外二区发光绝对量子产率高达21.8%,为目前已报道无毒近红外二区量子点的最高值。
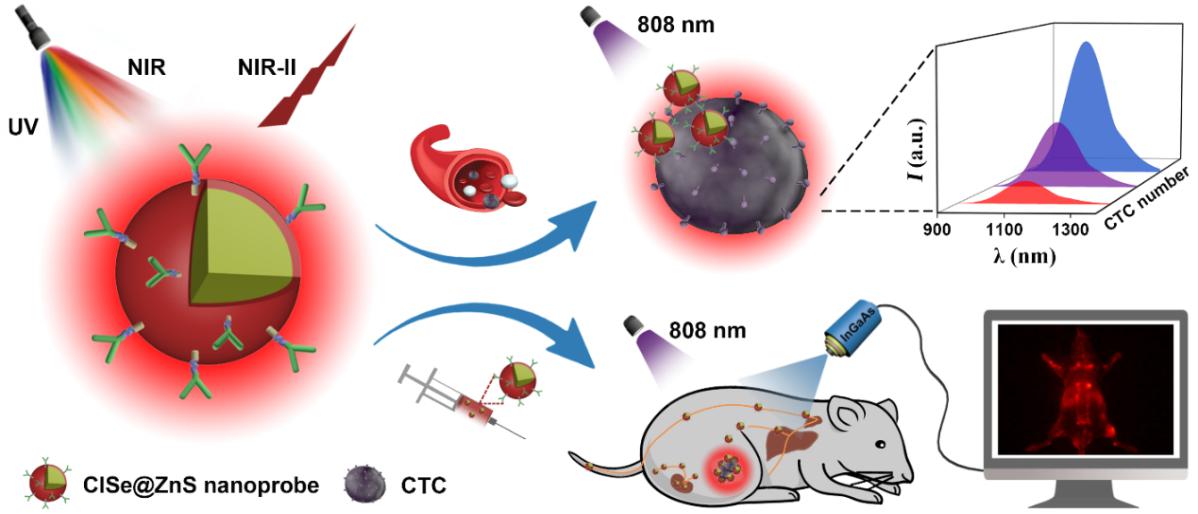
图1、基于CISe@ZnS新型近红外二区量子点生物探针的血液循环肿瘤细胞检测和肿瘤靶向实时成像示意图
进一步地,通过连接抗表皮细胞粘附分子(EpCAM)抗体,团队利用CISe@ZnS探针可以实现对CTC(如人类乳腺癌MCF-7细胞)的特异性识别,对血液样本中CTC的检测限可低至12个细胞/96孔(200 μL)。此外,团队还将CISe@ZnS基近红外二区发光探针应用于活体小鼠体内的肿瘤靶向实时成像,主要的器官和血管清晰可见,血管分辨率低至0.36 mm,信噪比高达5.8(图2)。值得注意的是,该探针在尾静脉注射4小时后即可通过肾通道和肝通道排出体外,展现出良好的生物相容性和易于代谢的优势。该工作为开发高效无毒近红外二区发光生物探针提供了新的思路,相关结果以全文形式发表在纳米领域旗舰期刊《今日纳米》杂志(Nano Today 2020, DOI: 10.1016/j.nantod.2020.100943),该论文的第一作者是物构所/福州大学联培硕士研究生廉纬,通讯作者为涂大涛副研究员和陈学元研究员。
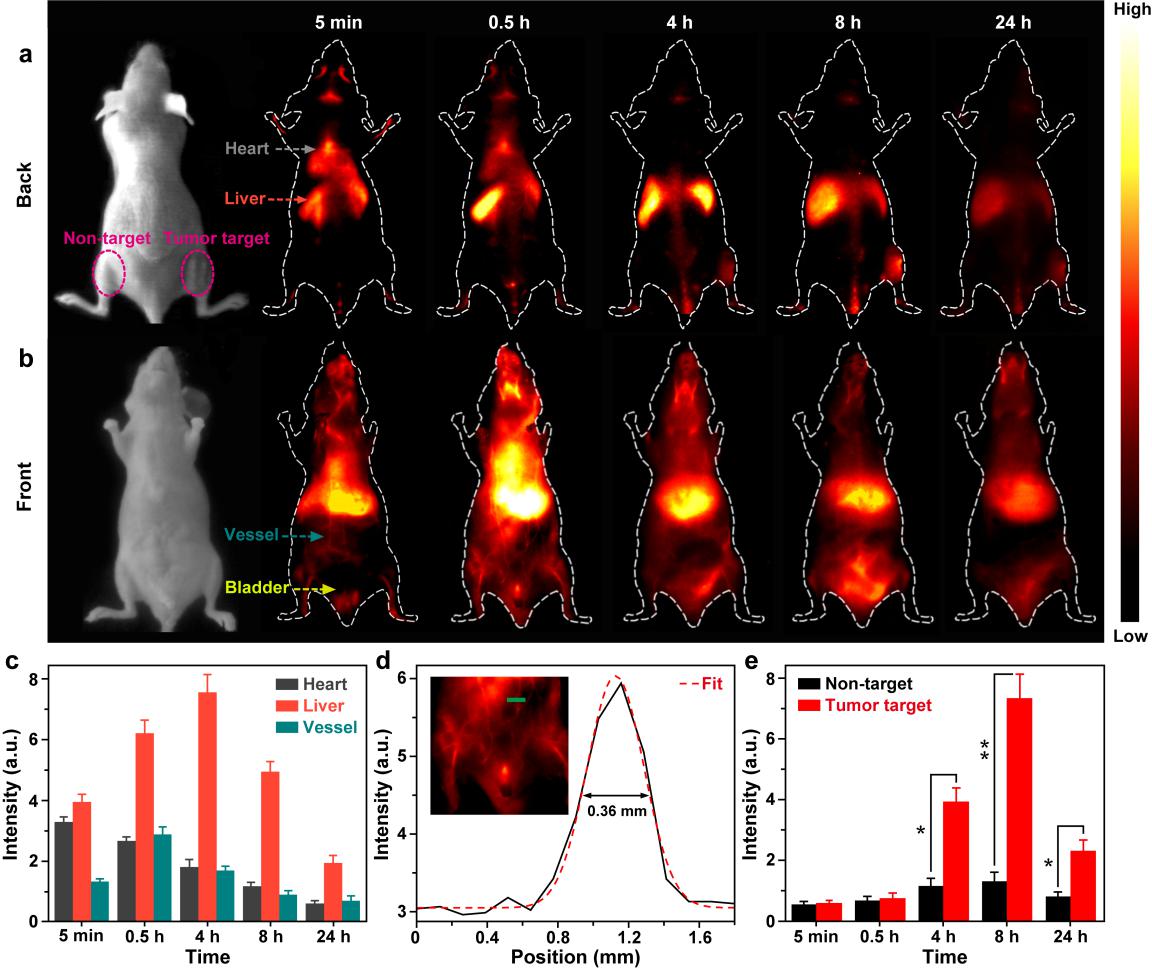
图2、活体小鼠a)背部和b)腹部明场像,以及静脉注射CISe@ZnS探针后的近红外二区成像图;c)注入探针后不同部位的发光强度变化;d)血管成像的分辨率;e)注入探针后肿瘤部位和非肿瘤部位发光强度变化
此前,陈学元团队在近红外二区发光生物探针的设计、合成及应用中已取得系列重要进展。例如,发展了高效NaCeF4:Yb,Er近红外二区发光纳米探针,实现对人体血清中尿酸的高灵敏检测及对活体小鼠组织的高分辨成像(Chem. Sci.2018,9, 4682-4688);研制了一种可用蓝光LED激发的CaS:Ce,Er近红外二区发光纳米探针,实现对人体血清黄嘌呤的特异性体外检测(Angew. Chem. Int. Ed.2019,28, 9556-9560);设计合成了氧化石墨烯包覆的稀土纳米探针NaYF4:Yb,Er@NaYF4@GO,实现了肿瘤细胞内microRNA可视化成像及肿瘤靶向的无背景近红外二区成像(Angew. Chem. Int. Ed.2019,5818981-18986)。
文章链接:https://www.sciencedirect.com/science/article/pii/S1748013220301122.
(陈学元课题组供稿)